Penurunan Persamaan Gas Ideal
Perhatikan
sejenis gas ideal yang terdapat dalam suatu bejana silinder di bawah ini.
Volume gas ideal ini dapat diubah dengan menggerakkan piston ke atas dan ke
bawah. Anggap bahwa bejana tidak bocor sehingga massa atau banyak mol gas itu
tetap. Persamaan keadaan gas ideal kita peroleh dengan dua cara berikut.
Cara
pertama, suhu gas dijaga tetap dan volume diubah-ubah dengan menggerakkan
piston. Misalnya tekanan gas mula-mula P0 dan volume gas mula-mula V0. Jika piston
digerakkan ke bawah hingga volume gas berkurang menjadi V0, ternyata tekanan gas bertambah menjadi 2P0. Jika piston tersebut digerakkan ke bawah sehingga volume
gas berkurang menjadi V0, ternyata tekanan gas bertambah
menjadi 4 P0. Hasil ini dapat disimpulkan oleh pernyataan berikut.
Jika
suhu gas yang berada dalam bejana tertutup (tidak bocor) dijaga tetap, maka
tekanan gas berbanding terbalik dengan volume
PV
= Tetap
P1V1 = P2V2
Hukum Boyle
Pernyataan
tersebut pertama kali dinyatakan oleh Robert Boyle pada tahun 1666,
sehingga disebut Hukum Boyle.
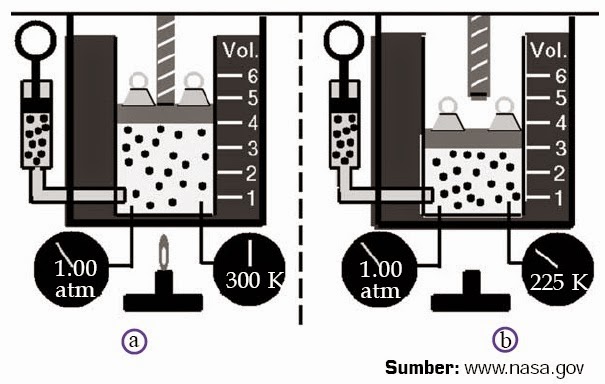
Cara
kedua, tekanan gas dijaga tetap dan volume gas
diubah-ubah menggerakkan piston. Diasumsikan suhu mutlak gas mula-mula
T0 dan volume gas mula-mula V0. Bila piston
digerakkan ke atas sehingga volume gas bertambah menjadi 2V0, ternyata suhu mutlak gas bertambah menjadi 2T0. Bila piston terus digerakkan ke atas sehingga volume gas
bertambah menjadi 4V0, ternyata suhu mutlak gas bertambah
menjadi 4T0. Hasil ini disimpulkan dengan pernyataan berikut.
Jika
tekanan gas yang berada dalam bejana tertutup (tidak bocor) dijaga tetap, maka
volume gas sebanding dengan suhu mutlaknya
(V/T) = Tetap
V1/T1 = V2/T2
Hukum Charles-Gay Lussac
Persamaan dinyatakan pertama kali
oleh Jacques Charles (1747-1823) dan Joseph Gay Lussac (1778-1805),
dan disebut Hukum Charles-Gay Lussac. Data suhu gas lebih sering
dinyatakan dalam to C. Suhu mutlak gas T yang
dinyatakan dalam satuan Kelvin dihitung dengan persamaan
T = t +173
Sekarang
kita dapat menyatakan persamaan gas ideal yang memenuhi Hukum Boyle dan Charles
Gay-Lussac
(PV/T) = Tetap
(P1V1)/T1 =
(P2V2)/T2
Persamaan Boyle-Gay Lussac
Jika
suhu mutlak T tetap, dihasilkan PV = tetap. Jika tekanan P tetap, dihasilkan (V/T)tetap. Jika massa atau mol gas diubah, misal kita menggandakan mol
gas, n, dengan menjaga tekanan dan suhu tetap, ternyata dihasilkan volume (V)
yang ganda (lipat dua) juga. Karena itu, kita boleh menulis bilangan tetap di
ruas kanan persamaan Boyle-Gay Lussac nR, dengan R diperoleh dari percobaan,
dan kita memperoleh persamaan umum yang berlaku untuk gas ideal, yang
disebut persamaan gas ideal.
Persamaan Gas Ideal
PV = nRT
Aplikasi Persamaan Keadaan Gas
Ideal pada Pernapasan
Ketika
Anda menarik napas, otot-otot mengembangkan dinding dada Anda dan menarik
diafragma ke bawah, membiarkan paru-paru yang elastis mengembang (volume udara
bertambah) menyebabkan tekanan di dalam paru-paru kira-kira 10 torr (1 torr = 1
mmHg) di bawah tekanan atmosfer. Tekanan dalam paru-paru yang lebih kecil
daripada tekanan atmosfer (tekanan udara luar) menyebabkan udara dari luar
memasuki paru-paru. Ketika otot relaks, jaringan paru-paru yang tadinya kencang
karena ditarik diafragma juga ikut relaks. Diafragma bergerak ke atas dan paru-paru
mengempis. Paru-paru mengempis menaikkan tekanan udara di dalam paru-paru,
sehingga udara dari paru-paru keluar.
Saat
Anda menarik napas, paru-paru mengembang, volume membesar, dan tekanan udara
dalam paru-paru berada di bawah tekanan atmosfer. Saat menghembuskan napas
paru-paru mengempis, volume mengecil, dan tekanan udara dalam paru-paru
meningkat.
sumber
: http://dianafisikaupi.wordpress.com/
Tidak ada komentar:
Posting Komentar